Page 239 - 201907
P. 239
第 7 期 李钰欣,等: 双氧水氧化乙二醛合成乙醛酸的连续流工艺 ·1485·
区。通过调节泵的流量和微通道的通道长度控制反 醛的转化率呈现先上升后趋于平缓的趋势。而乙醛
应停留时间,设定预热温度及反应温度。将底物乙 酸的选择性则呈现先上升后下降的趋势,当物质的
二醛、催化剂硫酸亚铁、溶剂水的混合液通过计量 量比达到 1∶1 时,乙醛酸的选择性达到最大,当物
泵 3 输入装置的预热区 5,双氧水通过计量泵 4 输 质的量比增大到(1.1~1.3)∶1.0 时,乙醛酸的选择性
入装置的预热区 6,在两股物料分别充分预热后, 急剧下降。这是由于随着氧化剂量的增加,体系中
进入反应区进行混合反应。乙醛酸产物从出口连续 双氧水浓度逐渐增加,使乙二醛得以被氧化成乙醛
出料,收集到产品收集器中,通过蒸馏分离得到产 酸的速率加快,然而,当双氧水浓度继续增大时,
物,产物经过 HPLC 分析。 由于体系中乙二醛的浓度降低,乙醛酸的浓度不断
1.3 分析方法 增加,所以乙二醛氧化成乙醛酸的速率小于乙醛酸
采用高效液相色谱法进行定量分析,条件为: 被双氧水氧化的速率,导致深度氧化副反应增加,
4.6 mm×250 mm C18 柱;检测波长 210 nm;流动相: 乙醛酸的选择性降低。因此,当双氧水与乙二醛物
pH 2.7 磷酸水溶液;柱温 25 ℃;流速 0.5 mL/min; 质的量比为 1∶1 时反应最佳,此时乙二醛转化率为
进样量 10 μL。 94.7%,乙醛酸的选择性为 85.4%。
乙二醛的转化率用内标法进行计算,选用的内 2.2 催化剂用量对反应的影响
标物为乙酸。乙醛酸的选择性用面积归一化法进行 在 n(H 2 O 2 )∶n(乙二醛)=1.0∶1.0,反应温度为
计算。 30 ℃,反应停留时间 10 min 条件下,改变双氧水
和硫酸亚铁的物质的量比,考察了催化剂用量对反
2 结果与讨论
应的影响,结果如图 5 所示。
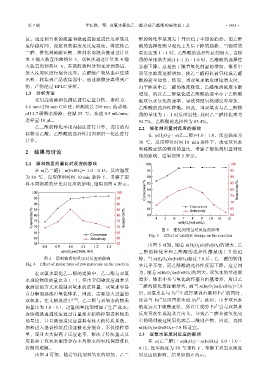
2.1 原料物质的量比对反应的影响
在 n(乙二醛)∶n(FeSO 4 )= 1.0∶0.13,反应温度
为 30 ℃,反应停留时间 10 min 条件下,考察了原
料不同物质的量比对反应的影响,结果如图 4 所示。
图 5 催化剂用量对反应的影响
Fig. 5 Effect of catalyst dosage on the reaction
由图 5 可知,随着 n(H 2 O 2 )/n(FeSO 4 )的增大,乙
二醛的转化率和乙醛酸的选择性都呈现上升的趋
图 4 原料物质的量比对反应的影响 势,当 n(H 2 O 2 )/n(FeSO 4 )超过 7.8 后,乙二醛的转化
Fig. 4 Effect of molar ratio of raw materials on the reaction 率几乎不变,而乙醛酸的选择性反而下降。这是因
在双氧水氧化乙二醛的实验中,乙二醛与双氧 为,随着 n(H 2 O 2 )/n(FeSO 4 )的增大,双氧水的量逐渐
水理论物质的量比为 1∶1,但由于间歇反应通常采 增多,体系中参与氧化的羟基自由基增多,所以乙
取滴加的方式来控制双氧水的进料量,双氧水容易 二醛的转化率逐渐增大,而当 n(H 2 O 2 )/n(FeSO 4 )>7.8
3+
2+
自分解而逃逸出氧化体系,因此,需要加入过量的 后,双氧水在与 Fe 生成羟基自由基和 Fe 的同时,
3+
2+
双氧水。在文献报道中 [16] ,乙二醛与双氧水的物质 还会与 Fe 反应再次生成 Fe 。此时,由于双氧水
2+
的量比为 1.0∶1.1,过量的氧化剂增加了生产成本; 浓度远大于硫酸亚铁,所以生成的 Fe 会与双氧水
连续流微通道反应通过计量泵来精确控制进料物质 反应再次生成羟基自由基,导致乙二醛在被氧化完
的量比,并且微通道反应器具有较大的传质系数, 全的同时被过度氧化成乙二酸副产物,因此,选择
原料进入混合模块后迅速被充分混合,不仅操作简 n(H 2 O 2 )/n(FeSO 4 )=7.8 较适宜。
单,而且大大提高了反应速率,解决了传统釜式反 2.3 双氧水浓度对反应的影响
应器由于双氧水浓度分布不均带来的氧化深度难以 在 n(乙二醛)∶n(H 2 O 2 )∶n(FeSO 4 )=1.0∶1.0∶
控制的难题。 0.13,反应温度为 30 ℃条件下,考察了双氧水浓度
由图 4 可知,随着氧化剂双氧水的增加,乙二 对反应的影响,结果如图 6 所示。